![]() 2017年度筑豊博物研究会雑誌原稿・第62号平成29年12月号掲載(出版者:筑豊博物研究会)予定
2017年度筑豊博物研究会雑誌原稿・第62号平成29年12月号掲載(出版者:筑豊博物研究会)予定
アフリカツメガエル発生学研究の紹介(1)
ジョン・ガードン博士のノーベル賞研究(核移植)を中心として
福岡医療専門学校
帝京大学理工学部(客員教授)・アジア日本語学院(学院長)
東京大学(名誉教授)塩川光一郎
1.はじめに
ガードン博士がそのクローンガエルの作出の業績に対してノーベル賞を授与される事が発表されたのは、2012年である。その年の9月、南フランスのギエンス半島で第14回国際アフリカツメガエル会議が開催された。5日間でプラットホーム講演が85題、ポスター発表が218題発表され、筆者もポスターセッションでアフリカツメガエル胚に対するポリアミン作用の研究についてささやかな発表(註1)を行った。
この国際会議も1984年に始まってから2017年の今では33年にもなる。2012年の学会の会期中にはガードン博士のノーベル賞の話題は全く出なかった。しかし、このヨーロッパの旅から日本に戻り10月の声を聞くと、ガードン博士が日本の山中伸弥京都大学教授と共にノーベル医学生理学賞を授与されるというニュースが新聞・テレビで大々的に報道された。それによると山中教授のiPS細胞は開発から6年というスピード受賞であるが、ガードン博士の受賞には50年もかかったとして『スロー受賞』などと評された。
筆者は2014年3月に帝京大学を定年退職し、2017年になって筑豊博物研究会の会員に入れていただいた。この機会に自分がこれまで研究してきた学問分野に関連のある形(アフリカツメガエルの発生生物学を中心にして)で、適当な解説を書いていくのが良いのではと考えた。そして、そのシリーズの第1番目のものとして、両生類を材料にしたガードン博士のノーベル賞研究(クローンガエルの作出)の解説を2017年度の冊子に出版して、筑豊生物同好会の皆さんにお配りするところから始めるのが良いのではと考え、このレビューをまとめた。
2.ガードン博士の発生生物学
ガードン博士はオックスフォード大学の大学院で核移植の先生であるフィッシュバーグ(M. Fischberg)教授の弟子として発生学を学んだ。そこでアフリカツメガエル胚を用いる核移植技術を学び、独自の工夫を加えて「核移植胚の発生は限定された範囲を越えて進むことは無い」という従来からの壁(BriggsとKingの一連の研究結果)(註2)を突破し、核移植胚を成体のカエルにまで発生させ、結局「クローンガエル」の作出に成功した。そして、このクローンの話は、後述するように、34年後に同じイギリスのスコットランドで、温血動物のヒツジ(ウイルムット博士の研究)に飛び火して、広く世間に知られるようになった。
ガードン博士のクローンガエルの一連の研究のまとめが世の中に発表されたのは1962年のことで、博士がまだ29歳の時である。しかし、ガードン博士自身はその核移植の研究を完成させると、世間ではあまり知られていないが新たなる展開を求めて、さっと米国カーネギー発生学研究所のブラウン(Donald
D. Brown)博士のもとに留学し、「見かけの研究の形」を全く異なるものに変えてしまった(解明しようとしている問題自体は、少しも変わってはいないのだが)。
ガードン博士はその短い留学の間に、当時の分子発生学の中心的なテーマの一つ、すなわち核小体(タンパク質合成を行う粒子であるリボソームを合成し、一時貯蔵し、細胞質へと送り出す機能を持つ、核の内部にある構造)とそれをつくる遺伝子に付いての細胞生物学的にも分子生物学的にも、さらには発生生物学的にも大変素晴らしい研究成果を挙げている(註3)。ここで、このガードン博士とブラウン博士が合流して行ったエレガントな共同研究の成功には、フィッシュバーグ教授の研究室で学生実習中に学生が発見した「リボソームRNA遺伝子が欠損しているために、核小体を作ることのできないゼローニュ・ミュータント(0-nu
mutant)」の胚が非常に役に立った(註4)。
ガードン博士はその次の展開として筋肉のα-アクチン遺伝子の発生学的な発現機構の研究を強力に推し進め、その過程でブラウン博士のカーネギー発生学研究所にポスト・ドクとして来ていたダーウィッド(Igor
B Dawid)博士(註5)と強い協力関係を構築する。そして発生過程における「成長因子」および「転写因子」の作用の解析の研究へとその研究の主力を注いで行くのである。こうして、当時の最先端の分子生物学を取り込んだ形態形成の仕組みを追求する新しい発生学を構築し、世界を引っ張る「より現代的な遺伝子発現調節の研究」の世界に入って行く。
このような流れを見ていくと、今回のノーベル賞を共同受賞した山中教授の研究も、アカデミックな角度からすると(つまり、治療のための研究という、人類への応用問題という角度ではなく)、このガードン博士がブラウン博士とダーウィッド博士の2人と協力し合いながら発展させてきた新しい形態形成の遺伝子調節学の展開の正に延長線上に現れるべくして現れた研究成果であるといえるものである(註6)。
図1・
ガードン博士(右)とその生涯の友人、ダーウィッド博士(中央)、およびブラウン博士(左)。この3人が3人とも、発生の分子生物学研究の世界的指導者である。世界のアフリカツメガエルの研究者の社会も、少なくともこの50年間は、この3人を中心として一つの学問の社会を構築してきた。筆者に言わせれば、この3人には、カーネギースタイルとも言うべき、独特の素晴らしいリサーチスタイルが持ち味である。すなわち、よくある大教授(自分のアソシエイト達にデーターをとらせ、自分は後方で指揮をするが、発表は自分が中心で行うという、一将功成なり万骨枯る、になりかねないスタイルの教授)とは真逆のリサーチスタイル、すなわち、どちらかといえば、いつも少数精鋭で、いつも自分の手でデーターを取りに行くスタイルであるという特徴がある。また、この3人の業績・貢献は一人アフリカツメガエルの発生の世界に留まらず、真核細胞生物の遺伝子発現コントロールの学問全体に広がっている。そして全体として今世紀における、いわばナイル川的な巨大な流れを形成しており、過去50年の歴史の中で、多くの学者がその中流、下流、海に近いところで巨大ナマズや、巨大ガー・パイクや巨大ピラルクを釣り上げては、その時々のノーベル賞をもらってきた、と言う風に動いてきた巨匠達だ。この写真は、その忙しい3人がケンブリッジでたまたま素晴らしい笑顔で談笑しているところを筆者が撮影したもので、筆者の非常に多くの国際会議の写真の中の、自慢の一枚である。時は、2002年のケンブリッジ大学ホマートン・カレッジでの第9回アフリカツメガエル国際会議(主催:ガードン博士)のコーヒーブレイク。ガードン博士は、第1回のこの会も1986年にイギリスのケンブリッジの北のナリッジで主催している(註7)
図1はその3人のパイオニアを讃えるために、近代的な遺伝子解析を基盤とした分子発生学の産みの親・育ての親達としてここに掲載しておく。
3.両生類の発生生物学におけるノーベル賞
今回のガードン博士によるノーベル賞受賞は、イモリのオーガナイザー(形成体)という「高等学校生物」の教科書のメインテーマの一つとなって久しい誘導現象の発見に対して出されたあの有名なノーベル賞以来のものだ。無尾両生類の発生学研究としては、実ははじめてのカエル研究ノーベル賞ということでもある。有尾類のイモリを用いてのオーガナイザーの発見は伝説的なドイツ人発生学者ハンス・シュペーマン(Hans
Spemann)(とヒルデ・マンゴールド、Hilde Mangold;ただし、マンゴールドは若くして他界したので、ノーベル賞受賞者にはなっていない)による業績であるが、その発見にノーベル賞が授与されたのは1935年のことである。よって、2012年の無尾類であるアフリカツメガエルにおけるガードン博士のノーベル賞は、シュペーマンのノーベル賞から実に77年後のできごとということになる。
生物学研究は一般的命題としての生物学的現象の解明が第1に重要なことであるので、材料にあまりこだわるのは、良いことかどうかは分からない。それにしても、日々研究に使っているアフリカツメガエルを使って明らかにされたことがノーベル賞に輝いたとなると、やはりそのカエルが特別に大事に思われるのもまた自然である。いずれにせよ、77年ものブランクの後に、再び両生類の研究にノーベル賞が授与されたことは大変喜ばしいことである。
4.ガードン博士のノーベル賞受賞研究(核移植)の概略
ガードン博士のノーベル賞研究であるアフリカツメガエルのクローン完成は1962年とされている。これは、それは1962年に発表された次の2つの論文によって、研究の最終的な結論が与えられたと認定されているからである。
【1】Gurdon (1962). The developmental capacity of nuclei taken
from intestinal epithelium cells of feeding tadpoles. Journal
of Embryology and experimental Morphology, 10, 622-640.(ガードン著:1962年。餌を食べるオタマジャクシの腸上皮細胞から分離した核のもつ発生能力。発生と実験形態学雑誌、10巻、622ー640ページ)。
【2】Gurdon (1962). Adult frogs derived from the nuclei of single
somatic cells. Developmental Biology, 4, 256-273.(ガードン著:1962年。単一の体細胞の核からつくられた成体のカエル。発生学雑誌、4巻、256ー273ページ)。
ここでこの研究に用いられた技術は「核移植」技術であるが、これは始めはアメーバーのような原生生物の細胞の間で、顕微鏡で見ながら、一方の細胞からガラスの微小管で核を抜き取りもう一方の細胞の中に注入するという、いわば単純な手術を意味していた。
ガードン博士のノーベル賞の対象になった核移植実験は上に挙げた2つの論文のうち、特に【1】のJEEM(註8)の論文である。ガードン博士はこの論文では、餌を食べる時期のアフリカツメガエルのオタマジャクシの腸の細胞を核のドナー(供与体)に選び、その核を、元からある核を紫外線照射であらかじめ不活性化しておいたアフリカツメガエルの未受精卵に(すなわち、核が壊された未受精卵の細胞質に)移植した。
ここで用いた腸の細胞はその粘膜の細胞に養分吸収のための微絨毛(これは小腸の輪状ヒダの絨毛の表面にあるので、小腸微絨毛と呼ばれる)をもっている。これは「刷子縁」という、日本家屋の縁側で言えば、50cmくらいに切った角材を並べたいわゆる「濡れ縁」のような外観をしている。従って、その刷子縁の存在により、腸の細胞が養分吸収という役割をもつ細胞に完全に特化(つまり、分化)した細胞であることが明瞭に確認でき、ガードン博士はそれ故にこの細胞の核を核移植の材料(核のドナー)に選んだのである。この核移植の結果、腸の核を移植された未受精卵はあたかも受精卵になったかのように分裂を開始し、初期の段階の胚(胞胚、細胞数4,000ー8,000の時期)まではスムーズに発生した。
ところが、予期されたことであるが、そこで得られた核移植胚はほとんどの場合、それ以上は発生できないことが明らかになった。そこで、ガードン博士は継代核移植あるいは連続核移植(serial
nuclear transplantation;あるいはserial nuclear transfer)を行うようにした。これは最初の核移植で得られた胚の中からなるべく正常に発生しているものを選び、その胚の割球(初期胚の細胞を、特に割球と呼ぶ)の中から特に順調に分裂しているものを選び、その核を再びガラス針で吸い出して紫外線照射により核を不活性化させておいた別の未受精卵の細胞質に移植したのである。図2にその連続核移植の説明図をガードン自身の著書の図(註9)に従って示す。
図2・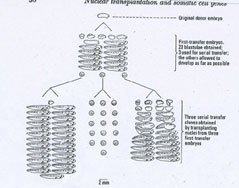
連続核移植の実験結果の一例。この実験では、尾芽胚の直前の時期の胚の内胚葉の細胞から核を分離し核移植を行った。20匹の核移植胚が得られたが、発生の仕方は個体毎に様々であった。その中の3匹の胞胚を選び、その核を更にもう一度別の未受精卵に核移植した。その2度めの核移植で得た胚の到達した発生段階は多くの場合、初期の泳ぐオタマジャクシ期であった。しかし、それより前の種々の段階で発生停止した胚もかなりみられた(上段)。連続核移植で得られた胚は図の下の3つのグループに示されているように、3様の発生の経過を辿った。一つは1個体を除く個体全体がオタマジャクシ期まで発生した(左)、他の一つのクローンはすべて胞胚期で発生停止した(中央)。しかし、他の一つは種々の形の異常発生が起こり、一定した結果には成らなかった(右)。下に示した短いバーは2mmの長さである。Gurdon
(1974)(註9)より。
ガードン博士はこうして、腸の細胞の核を未受精卵の細胞質に2度移植し、そうして得た核移植胚(継代核移植胚)を注意深く育て、成体のカエルにまで発生させることに成功した。【2】のDev.
Biol.の論文は、そのようにして作り出したクローンガエルが正常な生殖能力をもっている(正常な生殖細胞をも作ることができる)ことを示したものである。
5.ガードン博士が行った実験結果の更なる検定
(1)検定実験その1
ところで、上に得られた成体のカエルは確かに移植された核からもたらされたといえるだろうか。まず、紫外線で未受精卵の中に元からあった核を不活性化したと述べたが、この点はどうだろうか。核の中のDNAは紫外線を強く吸収するので、細胞に紫外線を当てるとDNAが傷だらけとなり壊れてしまう。しかし、紫外線で壊したと考えた未受精卵の核(この卵の核は第2分裂中期で泊まった、いわゆるメタフェーズ・アレストの状態にあり、この時点ではまだ2nである)が実は死なずに生存し、それがそのまま固まって2nの核となりそれによって成体のカエルが発生したという可能性はなかったのか、という疑問も生じないわけではない。
ガードン博士は自らこの疑問を掲げ、それに答える工夫を行った。彼はまず、核移植に用いる核として、核小体が1個しか無いという遺伝的特徴(これを、核マーカーという)を持った個体(フィッシュバーグ教授の研究室で学生実習中に発見されたもので、後にガードン博士が留学先のカーネギー研究所でブラウン博士との共同研究に使用したあのオックスフォード・ミュータント)を選び、遺伝的に核小体が1個の個体(註10)の細胞から核を分離して、それを移植した。一方で、未受精卵を提供する雌のカエルは遺伝的に細胞当たり(すなわち核当たり)2個の核小体をもつ野性型の雌から得た未受精卵に紫外線を照射してその核を壊し、それを受け入れ側(レシピエント)の細胞(この場合、卵)として用いた(註11)。そして、核移植体が尾芽胚になった時に尾の先端部分を切り取って、その組織片を押しつぶし、位相差顕微鏡を用いて核小体の数を数えた。その結果、核移植胚の細胞の核には核小体が1個しか無いことが確かめられた。ガードン博士は、これによって、得られた核移植ガエルは移植した核(核小体が1個)の分裂によって作り出されたと主張した。
ガードン博士はより最近では、核のドナーとして、遺伝的欠陥によってメラニン色素を作ることができなくなったアルビノ(白子)のカエルのオタマジャクシを用いている。彼はその白いオタマジャクシの皮膚の細胞の核を取り出し、それを移植することにした。このアルビノのオタマジャクシの皮膚の細胞は遺伝的に「色素を作ることができない」表現型になっているので、白い体をしている。この細胞の核を茶色のメスのカエルから産み出された茶色の未受精卵に核移植したところ、結果として得られたカエルではその「色素を作らない」という遺伝的性質が表現され、すべてがアルビノ(白子)のカエルに発生した(図3)。これは核マーカーの可視化である。
図3・
クローンガエルの写真。アルビノのオタマジャクシの皮膚の細胞の核を茶色いメラニン色素を作る性質を持った野生型のメスのカエルの卵(この卵の核は紫外線照射であらかじめ破壊しておく)に移植して、この19匹の核移植ガエルを作出した。核移植胚ははじめ茶色であったが、やがて移植された核の遺伝子の働きが表に現れ、結局白いカエルになった。これらの19匹のカエルはクローンガエルであり、拒否反応無しに皮膚の移植ができ、その遺伝子の組成、配列、数などが完全に同じである。白いカエルはすべて産卵管をもたない雄のカエルである。ということは、核の提供者であったオタマジャクシは雄であったことを意味している。この写真では、これらのクローンガエルは皆同じ方向を向いている。これは、氷で冷やした水の中では、すべてのカエルが動かなくなり、カエルの動きが止まってから向きをそろえ、写真を撮ったに違いないと思われる。最近、宮若市で小学生にカエルの講義をしたので、このことをガードン博士にメールで問い合わせたところ、「その通りだ」との返事が来た(撮影:ガードン博士)。
これらの結果から、クローンガエルに於いては、移植された核が確かに個体全体を作った、と結論できる事が分かる。
(2)検定実験その2
これは、核移植に使用されたドナーの核が、確かに完全に分化を終えたものであったかどうか、偶然に存在した未分化な細胞の核では無かったのか、を確かめるために行われた。ガードン博士は、このため、成体のカエルの後肢の水かきの細胞の核を核移植実験に使用した。この実験では、水かきの細胞をあらかじめ培養して分裂活性を高めると同時に、培養された水かきの細胞が分化マーカーとしての皮膚細胞特徴的なケラチン(細胞骨格タンパク質)を合成しているかどうかを免疫抗体法であらかじめ調べた。そして、培養された細胞の99.9%がケラチンを合成していることを確かめた(註12)。
この実験では、ガードン博士は129匹の核移植胚を作り、そのうちの6個体(すなわち、4.7%)が成体のカエルにまで育つことを確認した。未分化な細胞の核が偶然に核移植される確率は0.1/100であるのでここでの4.7/100の成功率は仮に1匹が未分化の細胞の核を偶然注入されてそのために成体にまで発生したとしても、残り3.7固体の核移植ガエルは、ケラチンを合成して皮膚の細胞に完全に分化していた細胞の核の移植から生じたものだということになる。従って、ケラチン合成に特化した(分化した)細胞の核がもう一度成体のカエルの全体を形成したということが「疑う余地の無い形で示された」と主張した。ガードン博士はこの結果をノーベル賞の元になったあの1962年の論文を発表したJEEMに1975年に発表している。
6.ガードン博士の研究と山中教授の研究の比較
今回のガードン博士と山中教授のノーベル賞は共同受賞ではあったが、この2つの研究については似たところと異なるところがある。ガードン博士の核移植による初期化と山中教授の転写因子導入による初期化の両方について、その似ている点と異なる点をここでまとめて解説する。
(1)両者の似ている点
ガードン博士の実験では成体の細胞の核が未受精卵の細胞質に移植された。そして、その移植核は新しい細胞質の中で受精卵の細胞の核に成り代わり、卵という1個の巨大な細胞に卵割を起こさせ何千(胞胚期)、何万(嚢胚期)という小さな細胞から成る多細胞の胚に変化させた。そして更に、その細胞群に一連の形態形成を行わせ、変態期を通過させ、すべての臓器のそろった、子供を作る能力を持ったカエルに変えた。
これに対し、山中教授の研究では、培養したヒトの皮膚の細胞に、Oct3/4、Sox2、Klf4、c-Mycの4つ(今や山中ファクターと便宜的に総称される)の、転写因子タンパク質の遺伝子をウイルス・ベクターに組み込み、その組み換え体ウイルスを培養皮膚細胞に感染させて、これら4つの因子の遺伝子を皮膚の細胞のDNAに組み込ませた。そして、それによって細胞の性質を変え、最終的にはいろいろの刺激に反応していろいろの細胞に変わり得る(分化しうる)iPS細胞が作り出された。山中博士の研究の場合、皮膚の細胞の核の中ではすでにその働きを終えて不活性になっていた上記の4つの転写因子遺伝子をウイルスの利用によって、外から強制的に細胞核に(おそらく、多数コピー)導入し、皮膚の細胞の46本の染色体DNAのあちらこちらにそれらの遺伝子を飛び込ませ、DNA鎖に安定的に組み込ませた。その結果、細胞当たりのそれら遺伝子のコピー数が増え、それら遺伝子の活性が表に現れ、皮膚の細胞の性質が変化し、結果的に「初期化」が起こったのである。
一般的には、核のDNA鎖に別のDNA断片が組み込まれると、その場所に元からあった遺伝子がメ挿入による突然変異insertional
mutationを起こす。飛び込んだ場所が機能的な遺伝子内部であれば、その遺伝子は破壊されることになる。よって、この場合、可能性としては遺伝子レベルで深刻な問題を抱えることにはなる(註13)。しかし、「初期化」の達成という点ではガードン博士の「初期化」と同じ事が起こったのである。
山中博士の研究では、こうして、分化を終え一つの分化形質に対応する仕事(遺伝子発現)を専門に行っている成体の細胞(その最初のものは皮膚細胞であるが)に、上記の4種類の遺伝子を新たに導入し、その導入遺伝子の働きが表に出るようにしむけて、細胞を多能細胞pluripotent
cell(multipotent cell)(註14)へと変化させたのである。
ガードン博士の場合も山中教授の場合も、分化を終え一つの形質発現に固定され安定化された状態にあった細胞の核の働きを、まるで発生の時計の針を巻き戻したかのように、受精後の初期の状態にもどすことに成功した。その点で、この2つの研究は同じような研究だったといえる。
(2)両者の異なる点
ガードン博士と山中教授は細胞の(核の)性質の「初期化」という言葉でまとめられて、2012年のノーベル医学生理学賞を授与された。ただし、前者はカエル卵の細胞質への核移植であり、後者はヒト細胞への遺伝子導入というように、初期化のために用いた手段は全く異なっていた。両者が用いた方法の違いの本質は何処にあるのだろうか。
まず材料であるが、ガードン博士の核移植には卵の直径が1.2mmもあるアフリカツメガエル卵が核を受け取る側として使われた。他方で、山中教授の用いた細胞はヒトの身体から分離した皮膚細胞である。しかし、この他に、この両者の研究スタイルの何処が違うのだろうか。
山中教授の場合は、遺伝子導入により皮膚の細胞の核は自分自身の細胞の細胞質の中に『居ながらにして』初期胚の未分化な時代の核に戻ったかのように振る舞った。この変化が「初期化」と呼ばれた。一方、ガードン博士の研究では、成体の分化した腸の細胞の核が一度抜き取られ、注入しやすい巨大な未受精卵という単一の細胞の細胞質中に移植された。いわば、元の場所に「居ながらにして」という山中教授の場合と異なり、ガードン博士の実験では、オタマジャクシの腸の細胞の核がガラスの針に吸い取られて強制的に卵という全く異なる細胞の細胞質の中に『引っ越し』させられたわけである。その引っ越しの結果、腸の細胞の核は予想もしていなかった卵の細胞質に閉じ込められ、その新しい細胞質の影響を受け、あたかも受精直後の卵の核のように核の性質を変え(実際、核の大きさも移植後は急激に大きくなる)、結果として「初期化」が起こったわけである。
移植された核は、卵の新しい細胞質環境の影響を受け、細胞質の種々の成分、特にタンパク質成分ムたぶん山中教授の選んだ4種類の山中因子タンパク質ムが引っ越してきた核の中に入り込み、クロマチンというDNAとタンパク質の複合体の中に分け入り、更にDNAの糸のあちらこちらに張り付いて(転写因子として結合して)核の働き方を変えてしまったものと思われる。
この点に関して、ドイツのマックス・プランク発生学研究所のリスティーヌ・ドライヤー博士(図4)はピーター・ハウゼン所長と共同で、未受精卵の細胞質の種々の特別の蛋白質(おそらく、その主要部分は、将来の形態形成をコントロールするための転写因子と考えられる)が発生の特別の時期に胚の特別の場所の細胞において、細胞質から核へ移動するという論文を発表している(図5)(註15)。このクリスティーヌの研究からしても、ガードン博士の研究では、おそらくは初期化に必要な種々の転写因子が卵の細胞質から移植核に乗り移り、その結果、移植核のDNAは自分の存在状態が受精直後の核の状態にもどった(あるいは、自分は元々受精卵の核であったのだ)と錯覚し、それから急に受精卵の核として振る舞うように「初期化」され、発生を繰り返したのだと考えられる。
まとめると、両者の実験は『居ながらにして(山中教授)』と『引っ越しして(ガードン博士)』の明確な違いがあった。しかしそれにも拘らず、両者の実験で問題となった核の内部でのできごとは、おそらく本質的に同じことだったと考えられるのである。
図4・
ドイツ、マックスプランク発生学研究所のクリスティーヌ(Christine Dreyer)博士。1994年8月に宮若市の筆者の家に来た時の写真である。
図5・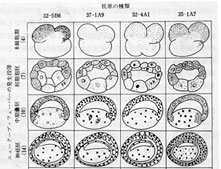
この実験のために卵核胞(卵母細胞の核のこと。あまりに大きいので核というのが不適当と感じられて、このように呼ぶ)法からの蛋白質を用いてマウスを免疫し、32ー5B6, 37ー1A9, 32ー4A1,および35ー1A7の4種類の抗体を作るハイブリドーマを作り、モノクローナル抗体を準備した。それを用いて、卵母細胞の成熟分裂(減数分裂)の段階で卵核胞から細胞質に分散して行った蛋白質(この図では4種類を選んである)が、発生の段階に入った後、特異的な時期に特異的な部位の細胞の核の中に集積していくことを示している。オリジナルの論文では細胞質や核に検出された「抗体に反応した蛋白質」は赤いドットで示してあるが、ここでは、黒のドットで示した。このドットは細胞質に存在する蛋白質、すなわち核に戻って行くべき抗原の存在を示している。Dreyer
et al.(15)。
7.この分野の研究の小史
この機会を捉えて、ガードン博士のクローンガエルの研究から山中教授のiPS細胞のノーベル賞に至るまでのこの分野の研究の歴史を年号に従って並べてみると、次のようになる。
・
1962年 イギリスのジョン・ガードン博士(クローンガエルの完成)
1981年 イギリスのマーティン・エバンス博士(マウスの胚性幹細胞、ES細胞;embryo stem cellの作成に成功)
1996年 イギリスのイアン・ウィルムット博士(クローンヒツジのドリーの誕生。このドリーを雄のヒツジとかけ合わせ、ボニーという仔ヒツジを産ませることができた)
2006年 日本の山中教授マウスのiPS細胞の作成に成功
2007年 エバンス博士にノーベル医学生理学賞が授与される
2007年 山中教授とトムソン博士がヒトのiPS細胞をそれぞれ独立に作成
2012年10月8日 日本の山中教授とイギリスのガードン博士が共同で2012年にノーベル医学生理学賞を獲得する
・
こうしてみると、今回のガードン博士のノーベル賞が山中教授のiPS細胞の成功を待って、ようやく与えられることに成った経緯がよくわかる。そう考えると、一部の新聞で紹介されたように、「自分の仕事の意味が(世の中の人々から)よく理解されるようになるには、山中教授の研究が世に出ることが必要だったと思う」というガードン博士の気持ちもよく分かる。いずれにせよ、山中教授のiPS細胞の成功は特に日本人としてまず第1にそれを喜ぶわけであるが、同時に、筆者の場合は「おかげでガードン博士のノーベル賞問題にも決着がついて良かった」とカエルの研究仲間として、心からホットした。ガードン教授にもっとも近い研究仲間の一人と自負する筆者としては、山中教授とガードン博士を「初期化」というコードワードで結びつけたノーベル委員会の今回の評価の仕方に対し、改めて敬意を表したい。
8.おわりに
今回、筑豊生物同好会の伝統ある雑誌の中に急にアフリカツメガエルのことを持ち込ませてくれたのであるが、筆者としてはこの機会を与えられたことに大変感謝している。筆者も自分の研究グループの研究室を持たない状態になって既に数年が経過してしまっているので、これからは、新発見はほとんど期待できない。よって、昔の事を思い出しながら、若い人に向けて発信しておくと良いと思われる歴史的事実を折に触れて書いておきたい。その第1号として適当かも知れないものとして、筆者が宇都宮の帝京大学に勤務しているときに最後に出版した本「ガードン卿:その研究と人柄の魅力(理工学社)2013」の表紙を図6として示しておきたい。因みに、この本は国会図書館に収録されているので、もし必要があれば、そこで見ることができる。また、全てのタイトルや小見出しに英語を付けておいたので、外国からの照会にも対応しやすいと思われる。
図6・

ガードン博士のノーベル賞記念の書物(塩川光一郎著2013 12 15 理工学社)。
註
(1)Shiokawa, K., Kondo, T., Takai, J., and Mishina, T. Polyamines
added in the culture medium induce cell dissociation at blastula
stage in Xenopus embryos by interfering withハcadherin function;
14thInternational Xenopusハconference, Giens Peninsula, France;September
9th-13th, 2012.(塩川・近藤・高井・三品:アフリカツメガエル胚の培養液に加えたポリアミンはカドへリンの機能を阻害して胞胚期で細胞解離を起こす)。
(2)この研究はBriggs, R., and King, T, J. (1952) Changes in the nuclei
of differentiating endoderm cells as revealed by nuclear transplantation.
J. Morphol., 100, 269-312.ハにまとめてある。この論文には、核移植により発生を開始したカエル初期胚が、最初のうちはうまく分裂しても、やがて分裂を止める細胞がたくさん現れ、結局、嚢胚期(細胞数が1万個程度の時期の胚)を越えて発生することのできた胚はほとんど無いことが示されている。
(3)この研究はガードン博士とガードン博士の留学先のブラウン博士との共同研究の形で発表されたつぎの2通の論文できわめてエレガントに解明された。Brown,
D. D., and Gurdon, J. B. 1964, Absence of ribosomal RNA synthesis
in the anucleolate mutant of Xenopus laevis. Proc. Natl. Acad.
Sci., USA, 51, 139-146.:Gurdon, J. B., and Brown, D. D. (1965).
Cytoplasmic regulation of RNA synthesis and nucleolus formation
in developing embryos of Xenopus laevis. J. Mol. Biol., 12, 27-35.
(4)このミュータント(別名をオックスフォード・ミュータント)のDNA構造の解析はシアトルのハッチンソンがん研究所のロン・リーダーRon
Reeder博士が行った。実はそれとは独立に筆者らの研究室の田代康介博士が、当時九州大学の「遺伝情報研究センター」のセンター長で後に東京大学教授・ヒトゲノム研究世界総裁になられた榊佳之博士の指導のもとに研究していた。その結果、われわれはこのミュータントでは約450個連続して存在するはずのリボソームRNA遺伝子は欠落し、遺伝子の両側のリボソームRNA遺伝子の痕跡が見つかるだけであることを明らかにした。しかし、この研究がわれわれ九大グループの論文として投稿される直前にシアトルのRon
Reederによって、Dev. Biol.に出版されるという残念な事になってしまった。その日、私はシアトルの友人(倉地幸徳博士)の家に泊まっていて、翌日Ron
Reederの研究室を訪問する予定になっていたところに、田代さんから国際電話があって、そこで「タッチの差で発表が遅れた」事情を伝えられて、複雑な思いでRon
Reederの研究室に赴いたのを良く覚えている。結局、われわれの論文はTashiro et al.,で、遺伝子構造と機能の世界的なレベルで一流のゲノムの雑誌である、Geneに出版されることになった。これは田代さんの博士論文になった研究であるが、今となっては苦い思い出と共に思い出す論文である。なお、このミュータント・ガエルの場合、自分の遺伝子に基づいてリボソームRNAを作ることができないので核小体を形成することもできない。よって、タンパク質合成を行う装置であるリボソームが発生の途中で足りなくなって、ステージ42という餌を食べるオタマジャクシの時期で死滅する。
(5)ダーウィッド博士が世界の発生学に与えた影響はガードン博士のそれと並んで、大変大きい。アメリカNIH(National
Institute of Health)の分子遺伝学の部長であったダーウィッド(Igor B. Dawid)博士が発案者/オーガナイザーとなって、1984年に世界初のアフリカツメガエル研究者の国際会議がアメリカのバージニアにあるエーリー・ハウス(Airlie
House)で行われ、それが出発点となって、1986年にガードン博士が世話役となって第1回の200人規模のアフリカツメガエル国際会議がイギリスで持たれた。以来、今日まで、2年毎にこの国際会議がダーウィッド博士とガードン博士を中心として世界各国で場所を変えながら続けられて、今日に至っている(但し、2017年の今日の時点では、ダーウィッド博士自身は、ここ2回くらいこの国際会議を欠席しており、本人によると、体力の関係で若い者に任せているというようなことだった)。1984年のダーウィッド博士が開催した最初のこの会は旅費・滞在費をアメリカのNIHが世話するという形で約30人(実際には、現地の人が何人か加わって、40人くらいにはなっていたが)のアフリカツメガエル研究のその当時の研究面での、世界のエキスパートを集めるワークショップの形で、5月24-26日に開催された。このコンファレンスは、長いアフリカツメガエル分子生物学研究の歴史のなかで特に記念すべき国際会議(第1回目のワークショップ)であったが、筆者は幸運なことに、上司の山名清隆先生の「時分は行かないから、君がいってくれ」という決定により、参加することができた(招待状には、旅費の関係で、どちらか一人だけ来てくれ、とのダーウィッドの意向があったのである)。当時のダーウィッド博士の意気込み実に大変なもので、招待状の文章の中程には、the
time is right for a special workshop dedicated to Xenopusハdevelopment
where most people directly working on this subject would meet(アフリカツメガエルの発生現象について直接的に仕事をしている人々が集まるための特別のワークショップを招集するということであるならば、「今」がまさにそれを行う正しい時だ(the
time is right)とあった。筆者はこの会から戻った後、会議の内容の全体を「学会見聞録」として、主催者のダーウィッド博士にチェックをしてもらった後に、雑誌「蛋白質・核酸・酵素、29巻、921ー929、1984」にまとめて出版した。ダーウィッド博士にチェックを求めたのは、会議の内容が基本的にはゴードン会議(Gordon
conference)に準じて、未発表のものばかりであり、引用できないものとして扱うということが参加者の暗黙の了解事項であったからである。
(6)実際、ガードン博士は冲永佳学長のお許しを得て、著者が帝京大学の理工学部に学長のゲストとしてお呼びし、2005年の11月に「遺伝子とクローン動物」というタイトルの講演を学生たちにしていただいた折りには、講演の最後に次のようにいわれた。「Oct3/4因子(現在では、山中ファクターの主たる成分として良く知られるようになった転写因子)をアフリカツメガエルの成体の細胞に導入して過剰発現させれば、多分多分化可能を獲得する」と。すなわち、ガードン博士は2005年のあの時すでに、「初期化」の因子としてOct3/4因子が鍵になるのでは、と指摘しておられたのを筆者はよく覚えている。このガードン博士の指摘が山中教授のマウスにおけるiPS細胞の樹立(2006年)の1年前であることを思うと、今となっては、「さすがにガードン博士は良く勉強して、形態形成のメカニズムがよく分かっているなー」と、感心してしまう。
(7)塩川光一郎、中辻憲夫、野村一也(1987)。ノーリッチ・カンファレンス「ツメガエル発生の分子生物学(第2回)」。蛋白質・核酸・酵素、32、271ー276。このナリッチの国際会議は、今にして思えば第1回としておくべきであったが、当時、この会が何時まで続くか不明であったし、何よりも、1984年の米国バージニアのワークショップを第1回の国際会議と数えていたので、ここには第2回としてしまった。関連記事は塩川光一郎:街・ひと・自然;カエル博士語る。ノーベル賞をつなぐ大学。西日本新聞朝刊筑豊版2017年11月16日、にも出版されている。
(8)JEEMはJournal of Embryology and experimental Morphologyという専門誌の略称。このJEEMという雑誌は、専門雑誌であるのにあたかも1冊ずつが単行本であるかのように布地で覆われた分厚いハードカバーの装丁になっていた。しかし、発表される論文はほぼ形態学といえる者が主流であり、どちらかというと、地味な雑誌という印象が強かった。そこで、イギリスの発生学者達が奮起し、雑誌の名前を「Development(発生)」に変え、分子生物学を取り込むことにより内容を一新した。筆者も新しい形になってすぐ、少し場違いの幹事もしたが、Shiokawa,
Fu, Kawazoe, and Yamana:Mode of action of ammonia on rRNA synthesis
in Xenopus laevis embryonic cells. Development, 100, 513-523,
1987(アフリカツメガエルの胚細胞のリボソームRNA合成に対するアンモにアの作用機構に関する論文)をこの雑誌に発表した。今はもうJEEMという雑誌は無いが、その跡継ぎであるDevelopmentは、今や、形態形成学の領域で活躍している若者の「登竜門」の機能をも果たす世界の中心的な専門誌である。
(9)J. B. Gurdon:『The control of gene expression in animal development』Oxford
Press (1972).おそらくこれがガードン博士の著した唯一の著書では無いかと思われる。
(10)核小体1個の個体は核小体1個のオスと核小体1個のメスの掛け合わせから2/4の割合で生まれる。後の1/2は核小体を2個持つ個体となり、後の1/2の個体は核小体を全く持たない個体となる。この最後の1/2の個体はリボソームを自力で作る事ができないために、ステージ42のオタマジャクシの時期(餌を食べ始める時期)になる頃に体調が伸び悩み、死滅する。
(11)カエル卵の卵成熟過程の変化がどのように起こるかであるが、これは実は核の遺伝子を倍増し、2nから4nにDNAを増やしておいてから、第1減数分裂の前期に入って行く。その段階(減数分裂の第1分裂の前期)で1ム2年をかけて将来個体を形成することのできる卵母細胞へと成長・成熟する。その間中、卵母細胞は減数分裂の第1分裂を前期で分裂を止めたままである。アフリカツメガエルの場合、その状態でホルモンが来ると第1減数分裂を終わり、第1極体を放出し、卵は減数分裂の第二分裂中期で止まったままの状態(メタフェーズ・アレスとmetaphase
arrst)で排卵される。その状態の卵母細胞の中に精子が突入してそれから、2nの卵母細胞は、減数分裂の第2分裂を再開して、第2極体を放出してゲノム組成を2nから1nに変えておいて、それから進入してきた精子の核(これは始めからnである)と合体して、そこで受精による変化として2nの状態となる。従って、ガードン博士が核移植に使用した未受精卵という細胞は、卵ではあるが、精子の進入を受けていないので、減数分裂はまだ第2分裂の中期で停止した状態にある。よって、核形はまだ2nのままであるので、何らかの理由でこの分裂が阻害され核がそのまま固定されれば、核小体を2個形成するだけの遺伝子をもった異常な核の形で固まるものと思われる。よって、ガードン博士の実験では、核小体を2個含むことのできる核を持った細胞(第1減数分裂は済ませて2nの状態になって、そこで止まっているかたちの卵母細胞)に核小体を1個しかもつことができない遺伝子組成の2nのミュータント個体の核が移植されたことになり、ガードン博士が意図した実験が実験として成り立ったかたちで行われた、と考えることができる。
(12)この場合、この細胞の核を用いて仮に1000回の核移植を行うと、そのうちの999回はケラチンを合成していることが確かめられた細胞の核、すなわち完全に分化した細胞の核が移植されたことになる。その際、たとえば、間充織の細胞(mesenchymal
cells)のような未分化な細胞が水かきの細胞群の中に混じっていてその細胞の核が偶然に移植されたとしても、それはたかだか1000回に1回の割合で起こるに過ぎないというわけである。
(13)そのオリジナルのiPS細胞作製のプロとコールでは、遺伝子レベルでの「挿入による突然変異」が危惧されたからであろう、2012年の雑誌ニュートン12月号の記事によると、iPS細胞作製のより新しい方法が模索されつつあるという風に書いてある。そこでは、宿主の染色体内に飛び込まずにその作用を現すことができるような、より都合の良い遺伝子運搬体を利用して山中ファクターの遺伝子を細胞に運ばせようという努力、あるいはそれを「核の内部ではあるが染色体の外」に存在させて、iPS細胞を作ろうという努力がなされているという。また、導入する4種類の遺伝子のうち、c-Myc遺伝子はそれが導入された細胞に活発な分裂能を与えるものと考えられているが、これは癌細胞を特徴づける転写因子として以前からよく知られていたものでもあるので、上記のニュートン誌の記事によると、このc-Myc遺伝子も他のもので代用する工夫がなされつつあるという。筆者は帝京大を退職してからはほとんど専門書はフォローしていないので、新聞などのマスメディアの流してくれる情報だけに頼ることになるが、それによると、2017年の現在では、iPS細胞を患者の細胞で作っておき、それを治療実験のモデル動物ならぬモデル細胞として利用し、難しい疾患の治療法を探索する方向の研究に力が入れられているようである。また、複数のiPS細胞のなから免疫原性antigenicityの少ないタイプの患者細胞を選び出し、増殖させてiPSストックとして蓄えておき、それを他の患者の治療に用いる方向も準備されているようである。
(14)こうして得られた細胞は、人工的に誘導され(induced)、多能性を持ち(Pluripotent)、幹細胞(Stem
cell)と同じ性質を持つに至ったものと見なせるので、この順序でその英語の頭文字を取って並べ、iPS細胞と名付けられたのである。
(15) Dreyer C. et al., 1982, Roux’s Arch., 191, 228-238.1
(2017年度筑豊博物研究会雑誌原稿・第62号平成29年12月号掲載予定の原稿です。出版者:筑豊博物研究会)
![]() 2012年度ノーベル賞受賞ガードン博士関連
2012年度ノーベル賞受賞ガードン博士関連
■ 2012年度ノーベル賞受賞記念出版
「ガードン卿:その研究と人柄の魅力」/ 塩川光一郎・千次代 ガードン博士へ送った 追悼文
■ 2017年度筑豊博物研究会雑誌原稿
■ 医学生理学に貢献するアフリカツメガエル
■ ギリシャのクレタ島での第16回 アフリカツメガエル国際会議
■ アフリカツメガエル歴史の一部
■ 柔整ホットニュース ビッグインタビュー
■ 電子書籍出版の計画
■ 生命科学を学ぶ人におくる大学基礎生物学 塩川光一郎(著)
■ 作品一覧 塩川光一郎(著)
■ 単行本検索 塩川光一郎(著)